|
Unterrichtseinheit
Metalle, Salze und Energie
|
Metallische Bindung
Die chemische Bindung, die in den Metallen zwischen positiv geladenen Metall-Atomrümpfen und dem Elektronengas wirkt, wird als metallische Bindung bezeichnet.
Aufbau von Salzen
aus Ionen
Ionenbindung
Zusammenhalt von Kationen und Anionen durch elektrostatische Anziehungskräfte;
Kation
positiv geladenes Ion
Anion
negativ geladenes Ion
Elektrolyse von Salzen
mit Gleichstrom entladen sich Kationen an der Kathode, Anionen an der Anode;
z.B. CuCl2(aq)
Anode: 2 Cl¯ —> Cl2 + 2 e¯
Kathode: Cu² + 2e¯ —> Cu + 2e¯ —> Cu
Ionengitter
regelmäßige Anordnung von Ionen in einem Ionenverband durch elektrostatische Anziehungskräfte entsteht die Ionenbindung
Gitterenthalpie
freiwerdende Energie, wenn gasförmige Kationen und Anionen zusammentreten;
Mit zunehmender Gitterenergie nimmt der Schmelzpunkt zu und die Löslichkeit in Wasser ab.
Standard-Bildungsenthalpie  HB° HB°
Reaktionswärme, die bei konstantem Druck und Standartbedingungen bei der Bildung eines Mols einer Verbindung aus den Elementen gebildet oder benötigt wird.´
H2 + ½ O2 —> H2O(g)  HB° = –242 kJ HB° = –242 kJ
Standard-Reaktionsenthalpie 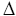 HR° HR°
Reaktionswärme, die bei konstantem Druck und Standardbedingungen,
bei einer Reaktion auftritt:
2H2 + O2 -> 2H2O(g) 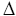 HR° = –484 kJ HR° = –484 kJ |