|
Unterrichtseinheit
Struktur und Eigenschaften Molekularer Stoffe
|
Übergang zwischen den Aggregatszuständen
Gegeben sei ein beliebiger Stoff, der bei einer bestimmten Temperatur im festen Zustand vorliegt. Dieser Stoff wird in einem offenen Gefäß langsam erwärmt, so dass sich die folgenden Änderungen ergeben:
| Aggregatszustand |
fest |
flüssig |
gasförmig |
|
| |

|
zugeführte Energie |
| |

|
Temperatur |
| |

|
Dichte |
Folgerungen für
die Teilchenebene |

|
Bewegungsenergie
(Geschwindigkeit)
der Teilchen |
| |

|
mittlerer Teilchen-
abstand |
| Folgerung: |
Zwischen den Teilchen eines Stoffes wirken Anziehungskräfte.
Zur Überwindung dieser Anziehungskräfte muss dem Stoff und damit den Teilchen Energie zugeführt werden. Die Folge ist eine Zunahme der Bewegungsenergie der Teilchen und damit eine Zunahme des mittleren Teilchenabstandes. |
Vergleich der Siedetemperaturen verschiedener Stoffe
| Stoff |
Siedetemperatur |
aufgebaut aus: |
| |
|
|
| NaCl |
+1465°C |
Ionen |
| |
|
|
| Cl2 |
-34°C |
unpolare Moleküle |
| Br2 |
+59°C |
unpolare Moleküle |
| I2 |
+186°C |
unpolare Moleküle |
| |
|
|
| HF |
+20°C |
polare Moleküle |
| HCl |
-85°C |
polare Moleküle |
| HBr |
-67°C |
polare Moleküle |
| HI |
-35°C |
unpolare Moleküle |
Van-der-Waals-Kräfte
1873 von Johannes van der Waals postuliert (niederländischer Physiker) und
1930 von Fritz London erklärt (deutsch-amerikanischer Physiker).
Die Antreffwahrscheinlichkeit der Elektronen in einem Molekül oder Atom ist nicht konstant, sondern ändert sich ständig. Dadurch kommt es zu lokalen Schwankungen der Ladungsdichte in der Elektronenhülle. Die Folge ist, dass selbst ungeladene Moleküle und Atome temporäre Dipole sind.
Nachbaratome bzw. Nachbarmoleküle sind ebenfalls temporäre Dipole. Wenn diese temporären Dipole nahe beieinander sind, so richten sie sich aufeinander aus, d.h. die positive Teilladung des einen Teilchens befindet sich möglichst nahe an der negativen Teilladung des anderen Teilchens. Dadurch ist die potentielle Energie des Systems am geringsten. Die Folge der Ausrichtung ist eine Anziehungskraft zwischen den Molekülen oder Atomen: Van-der-Waals-Kraft.
Die Van-der-Waals-Kräfte hängen von der Polarisierbarkeit der Teilchen ( = Leichtigkeit mit der Ladungsverschiebungen in einem Teilchen auftreten) ab. Die Polarisierbarkeit ist um so größer, je größer die Teilchenoberfläche ist.
| Zusammenfassung: |
Van-der-Waals-Kräfte sind Anziehungskräfte, die zwischen nicht verbundenen Atomen oder Molekülen wirken.
Sie sind um so größer, je größer die Teilchenoberfläche ist.
Die Reichweite der Van-der-Waals-Kräfte ist gering.
Beachte:
Van-der-Waals-Kräfte wirken sowohl zwischen Atomen und unpolaren Molekülen wie auch zwischen polaren Molekülen. Allerdings treten zwischen polaren Molekülen zusätzliche Anziehungskräfte auf. |
Dipol-Dipol-Kräfte
Ein Fluor-Molekül und ein Hydrogenchloridmolekül besitzen etwa die gleiche Moleküloberfläche gleich große Van-der-Waals-Kräfte: Zu erwarten sind deshalb gleiche Siedetemperaturen für die Stoffe Fluor und Hydrogenchlorid. Die Messung der Siedetemperaturen zeigt jedoch, dass Hydrogenchlorid erst bei einer viel höher Temperatur siedet.
| Stoff |
Siedetemperatur |
| Fluor |
-188°C |
| Hydrogenchlorid |
- 85°C |
| Folgerung: |
Zwischen den Hydrogenchloridmolekülen wirken zusätzliche Kräfte, die die höhere Siedetemperatur verursachen. |
| Erklärung: |
Hydrogenchloridmoleküle sind permanente Dipolmoleküle, da die an der Atombindung beteiligten Atome sich in ihrer Elektronegativität unterscheiden. So ist das Chloratom elektronegativer (EN = 2,8) als das Wasserstoffatom
(EN = 2,2). Die Folge ist eine unsymmetrische Verteilung des bindenden Elektronenpaares (polare Atombindung) und in diesem Fall auch ein polares Molekül. |

Die energetisch günstige Anordnung von Dipolmolekülen zeigt die folgende Grafik:
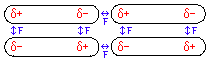
Zwischen den permanenten Dipolen herrschen neben den Van-der-Waals-Kräften zusätzliche Dipol-Dipol-Kräfte (F), die die Ursache der höheren Siedetemperatur sind.
Zusammen-
fassung: |
Dipol-Dipol-Kräfte sind Anziehungskräfte zwischen polaren Molekülen (permanenten Dipolen).
Sie sind um so größer, je polarer die Moleküle gebaut sind.
Dipol-Dipol-Kräfte wirken bei polaren Molekülen zusätzlich zu den immer vorhandenen Van-der-Waals-Kräften. |
Beispiele zu den Van-der-Waals-Kräften und Dipol-Dipol-Kräften
| Stoff |
Siedetemperatur |
aufgebaut aus: |
 |
| Cl2 |
-34°C |
unpolaren Molekülen |
| Br2 |
+59°C |
unpolaren Molekülen |
| I2 |
+186°C |
unpolaren Molekülen |
| Stoff |
Siede-
temperatur |
aufgebaut aus: |
 |
Elektronegativitäts-
unterschied: |
| HCl |
-85°C |
polaren Molekülen |
0,6 |
| HBr |
-67°C |
polaren Molekülen |
0,5 |
| HI |
-35°C |
unpolaren Molekülen |
0 |
Im Gegensatz zum HI-Molekül sind die HBr- und HCl-Moleküle permanente Dipolmoleküle, d.h. es wirken zwischen den HBr-Molekülen und zwischen den HCl-Molekülen zusätzlich Dipol-Dipol-Kräfte. Wie der Verlauf der Siedetemperaturen zeigt, überwiegen in diesem Beispiel die Van-der-Waals-Kräfte.
|
| HF |
+19°C |
polaren Molekülen |
? |
1,9 |
Wasserstoffbrückenbindungen
Hydrogenfluorid besitzt eine unerwartet hohe Siedetemperatur.
| Stoff |
Siedetemperatur |
aufgebaut aus: |
Elektronegativitäts-
unterschied: |
| HF |
+19°C |
polaren Molekülen |
1,9 |
| HCl |
-85°C |
polaren Molekülen |
0,6 |
| HBr |
-67°C |
polaren Molekülen |
0,5 |
| HI |
-35°C |
unpolaren Molekülen |
0 |
Diese abnormal hohe Siedetemperatur ist die Folge von Wasserstoffbrückenbindungen, die sich zwischen dem H-Atom eines HF-Moleküls und dem F-Atom eines anderen HF-Moleküls ausbildet:
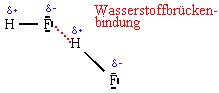
Wasserstoffbrückenbindungen sind zwischenmolekulare Kräfte, die zusätzlich zu den Van-der-Waals-Kräften auftreten. Ihre Ursache ist eine elektrostatische Wechselwirkung zwischen einem positiv polarisierten Wasserstoffatom und 2 stark elektronegativen weiteren Atomen (N, F oder O-Atome).
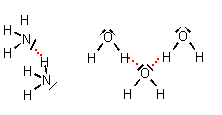
Die Ausbildung von Wasserstoffbrückenbindungen erfolgt zwischen Molekülen, bei denen entweder
• ein Wasserstoffatom direkt kovalent an ein stark elektronegatives Atom (N, F oder O)
gebunden ist (z.B. H2O, HF, NH3)
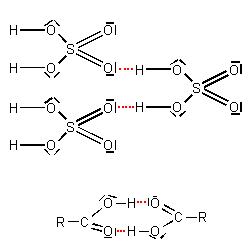
• oder ein Wasserstoffatom direkt kovalent an ein stark elektronegatives Atom (N, F oder O)
gebunden ist und weitere gebundene Atome vorhanden sind, die ebenfalls negativ
polarisiert sind (N, F oder O), aber nicht dirket an ein Wasserstoffatom gebunden sind
(z.B. H2SO4, Alkansäuren).
Wichtige Begriffe zur Unterrichtseinheit
Dissoziationsenthalpie
Energiebetrag, der aufgewendet werden muss,
um Moleküle in die einzelnen Atome zu spalten. H > 0;
z.B. H(H2) = + 435 kJ
Bindungsenthalpie
Freiwerdende Energie bei der Bildung eines Moleküls aus den Atomen. H < 0;
z.B. H(H2) = – 435 kJ
Elektronenpaarbindung (=Atombindung, =kovalente Bindung)
Bindung zwischen Atomen eines Moleküls durch ein bis drei gemeinsame Elektronenpaare.
Nichtbindendes (= freies) Elektronenpaar
Elektronenpaar, welches einem Atom allein "gehört".
Bindigkeit
Anzahl der Elektronenpaare, welche ein Atom mit den anderen Atomen des Moleküls teilt. z.B. N: kann 3 bzw. 4-bindig sein.
Mehrfachbindung
z.B. Doppel-und Dreifachbindung.
Sie haben einen geringeren Bindungsabstand und die Bindungsenthalpie ist größer. Achtung: es gibt keine 4-fach-Bindung.
Valenzstrichformel
Schreibweise von Atomen oder Molekülen,
bei welcher alle Valenzelektronen angegeben werden;
Molekülgeometrien
- linear (z.B. HCl)
- trigonal eben (z.B. SO3)
- tetraedrisch (z.B. CH4)
- pyramidal (z.B. NH3)
- gewinkelt (z.B. H2O)
- oktaedrisch (z.B. SF6)
Elektronenpaarabstoßungstheorie
Freie Elektronenpaare brauchen mehr Platz als bindende. Alle Elektronenpaare stoßen sich gegenseitig ab und nehmen den maximalen Abstand zueinander ein.
Elektronegativität
Bestreben eines Atoms das bindende Elektronenpaar an sich zu ziehen.
Innerhalb einer Periode nimmt sie von links nach rechts zu und innerhalb einer Hauptgruppe nimmt sie von oben nach unten ab.
polare Atombindung
Unterschiedliche Elektronegativitäten der verbundenen Atome bewirken,
dass die Elektronen nicht mehr gleichmäßig verteilt sind.
z.B. 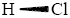
Teilladung
Polare Moleküle besitzen Teilladungen.
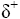 = Delta plus und = Delta plus und 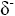 = Delta Minus = Delta Minus
z.B. 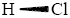
Dipolmolekül
Fallen die Ladungsschwerpunkte in einem Molekül nicht zusammen so ergeben sich Dipolmoleküle.
Achtung: z.B. CH4, CO2 sind keine Dipolmoleküle!
Zwischenmolekualare Kräfte
Anziehungskräfte zwischen Molekülen.
Van-der-Waals-Kräfte (= London-Kräfte)
schwache Anziehung zwischen unpolaren Teilchen durch spontane und induzierte Dipole.
Sie sind umso größer, je größer die Oberfläche der Teilchen ist.
z.B. CH4 > C2H6
Dipol-Dipol-Wechselwirkungen
starke Anziehung zwischen permanenten Dipolen.
z.B. H2S, HBr
Lösungsenthalpie
Energieumsatz beim Auflösen eines Stoffes in einem Lösungsmittel.
Wasserstoffbrückenbindungen
sehr starke Dipol-Dipol-Wechselwirkungen zwischen
H-Atomen und stark elektronegativen Atomen ( F, O, N )
z.B. NH3, HF, H2O
Hydratation
Ionen werden von einer Hülle aus Wassermolekülen umgeben.
Dabei bildet sich eine Hydrathülle.
Hydratationsenthalpie
Freiwerdende Energie bei der Ausbildung der Hydrathülle. |