|
Unterrichtseinheit
Stoffe und Reaktionen
|
Stoffgemische und Reinstoffe
Unterscheidung von Stoffen - Stoffeigenschaften
Gegenüberstellung von gleichen Gegenständen aus verschiedenen Materialien (z.B. Kugeln) und verschiedenen Gegenständen aus dem gleichen Stoff.
Ein Stoff ist charakterisiert durch seine spezifischen Eigenschaften, z.B.
Farbe, Geruch, Härte, Schmelzpunkt, Siedepunkt, Löslichkeit, elektrische Leitfähigkeit, Dichte, Brechungsvermögen, Oberflächenglanz, Kristallform, Verformbarkeit usw.
Versuche
| Schmelzpunkt |
(Naphthalin 81°C, Eis 0°C) |
| Siedepunkt |
(Alkohol 78°C, Wasser 100°C) |
| elektrische Leitfähigkeit |
Wasser, Zuckerlösung, Kochsalzlösung, Eisen, Kupfer, Schwefel |
| Geruch |
(Ammoniaklösung, Benzaldehyd) - Demonstration des "chemisch Riechens" |
| Löslichkeit |
Kochsalz, Traubenzucker, Kohlenstoff in Wasser, Alkohol und Benzin mit tabellarischer Protokollierung der Ergebnisse: |
|
|
Wasser |
Alkohol |
Benzin |
|
Kochsalz |
+++ |
- |
- |
|
Traubenzucker |
++ |
++ |
- |
|
Kohlenstoff |
- |
- |
- |
Brechungsvermögen (Diamant, Zirkonia)
Härte (Beispiele: Diamant, Graphit, Talk)
Mohssche Härteskala: Ritzhärte
|
|
Wird geritzt von: |
|
Talk |
Fingernagel |
|
Gips |
Fingernagel |
|
Calcit |
Messer |
|
Fluorit |
Messer |
|
Apatit |
Messer |
|
Orthoklas |
Glas |
|
Quarz |
Glas |
|
Tpas |
Glas |
|
Korund |
Glas |
|
Diamant |
Glas |
homogene und heterogene Stoffgemische
In der Praxis treten meist Stoffgemische auf.
Beispiele
Granit, Meerwasser
homogene Stoffgemische: einheitliches Aussehen
Beispiel
Kochsalzlösung
heterogene Stoffgemische: verschiedene Bestandteile (Phasen) lassen sich unterscheiden.
Beispiel
Granit (Feldspat, Quarz, Glimmer)
Die homogenen Anteile eines heterogenen Gemisches bezeichnet man als Phasen.
Granit besteht demnach aus drei festen Phasen:
|
Aggregatzustände (Phasen) |
fest |
flüssig |
gasförmig |
|
fest in |
(festes)
Gemenge |
homogen: Lösung
(Destilation
heterogen: Suspension
(Filtration) |
Rauch, Satub |
|
flüssig in |
Gel |
homogen: Lösung
(Destillation)
heterogen: Emulsion
(Scheiderichter) |
Nebel |
|
gasförmig in |
poröses Material |
homogen: Lösung
heterogen: Schaum |
Gasgemisch |
Trennung von Stoffgemischen - Gewinnung von Reinstoffen
Anwendung von Trennverfahren, z.B. bei der Erdölverarbeitung, Trinkwasseraufbereitung.
Filtration (Trennung von Suspensionen)
Versuch
Trennung eines Gemisches aus Kochsalz und Kohlenstoff.
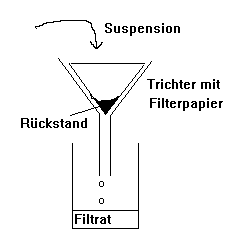
Unterschiedliche Stoffeigenschaften (hier: Löslichkeit) ermöglichen die Trennung.
Rückgewinnung des Kochsalzes durch Verdunstenlassen des Wassers oder durch Eindampfen.
andere Möglichkeiten: Sedimentation, Zentrifugieren, Dekantieren.
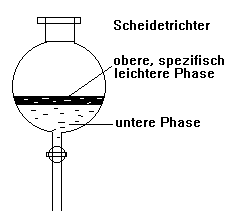
Scheidetrichter (Trennung von Emulsionen)
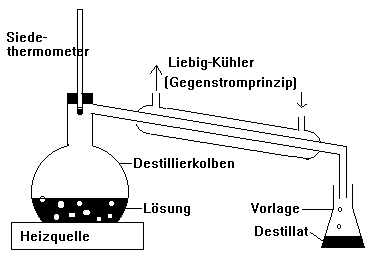
Destillation (Trennung von Lösungen)
Destillieren: Verdampfen und nachfolgendes Kondensieren
Versuch
Destillation eines Gemisches aus Wasser, Kochsalz und Kaliumpermanganat.
Chemische Reaktion
Abgrenzung der chemischen Reaktion vom physikalischen Vorgang
Versuche: Beobachtungen beim Erhitzen von Substanzen
1. Kupferblech in die Flamme halten —› Bildung eines schwarzen, blättrigen Überzuges
2. Magnesiumband in der Flamme —› verbrennt unter heller Lichterscheinung
3. Naphthalin erwärmen —› schmilzt und erstarrt wieder
4. Kupfersulfat erhitzen —› eine farblose Flüssigkeit entweicht (Wasser) und es bleibt ein
weißer, fester Rückstand, der bei Zugabe von Wasser unter Erwärmung wieder blaues
Kupfersulfat ergibt.
- Hinweis auf die Möglichkeit der Energiespeicherung! eigene Untersuchungen? - Sonnenenergienutzung?
Frage
Sind das alles chemische Vorgänge?
Vorgänge, bei denen sich nur der Zustand eines Stoffes ändert, nennt man
physikalische Vorgänge (z.B. Aggregatzustandsänderungen, Lösung, Kristallisation).
Bei chemischen Vorgängen treten bleibende Stoffänderungen ein. Die neu entstandenen Stoffe besitzen andere Eigenschaften als die Ausgangsstoffe!
Reaktion von Kupfer mit Sauerstoff, quantitativ
Frage
Wie lässt sich die Veränderung des Kupfers beim Erhitzen an der Luft erklären?
(Analogie: Rosten von Eisen)
Sammlung von Deutungsversuchen für die Veränderungen beim Erhitzen von Kupferblech an der Luft (Massenzunahme oder Massenabnahme?).
Hypothese: Kupfer verbindet sich mit Sauerstoff zu einem neuen Stoff.
- die Reaktion sollte mit reinem Sauerstoff statt mit Luft noch leichter ablaufen,
dagegen nicht in Stickstoff (Kupfer müsste blank bleiben).
- Sauerstoff müsste verbraucht werden.
Versuch
Erhitzen von Kupferpulver mit Sauerstoff in einem abgeschlossenen Volumen
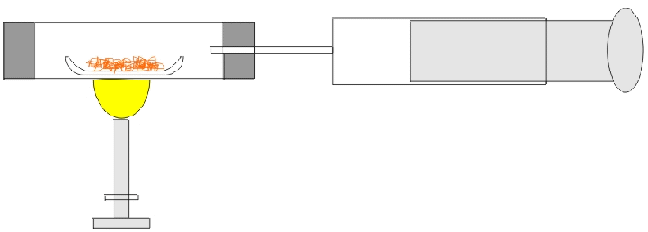
Beobachtung
Reaktion unter Aufglühen - Bildung eines schwarzen Pulvers.
Volumenabnahme um 22 cm³.
Massenzunahme des Schiffchens um 33 mg.
Entspricht die beobachtete Massenzunahme am Kupfer einer gleichgroßen Massenabnahme beim Sauerstoff?
Dichte (Sauerstoff) = 1,33 g/l (bei 20°C)
Berechnung der Masse von 22 cm³ Sauerstoff (20°C)
Ergebnis: 29,3 mg
Ergebnis
Bei der Reaktion von Kupfer mit Sauerstoff ist eine Verbindung von Kupfer mit Sauerstoff entstanden: Kupferoxid.
Grundypen chemischer Reaktionen: Zusetzung (Analyse), Aufbau (Synthese) und Umsetzung
Wasserstoff + Sauerstoff —› Wasser
Kupfer + Sauerstoff —› Kupferoxid
Magnesium + Sauerstoff —› Magnesiumoxid
Eisen + Schwefel —› Eisensulfid
Kupfer + Schwefel —› Kupfersulfid
allgemein gilt: A + B —› AB
Synthese: Aufbau einer Verbindung, z.B. durch Vereinigung zweier Elemente
Elektrolyse
Wasser —› Wasserstoff + Sauerstoff
Versuch
Erhitzen von Silberoxid, Nachweis des entstehenden Sauerstoffs durch die Glimmspanprobe,
Silber wird am Metallglanz erkannt.
Silberoxid —› Silber + Sauerstoff
Hinweis, dass diese Reaktion nicht verallgemeinerungsfähig ist (Edelmetall)
allgemein: AB —› A + B
Analyse: Zerlegung einer Verbindung, z.B. in die Elemente, aus denen sie entstanden ist.
viele Reaktionen laufen komplizierter:
Versuch
Reaktionen von Magnesium mit Wasserdampf
Magnesium + Wasser —› Magnesiumoxid + Wasserstoff
allgemein: AB + C —› AC + B
Umsetzung: Kopplung von Analyse und Synthese.
Verbindung und Elemente
Versuch
Elektrolyse des Wassers
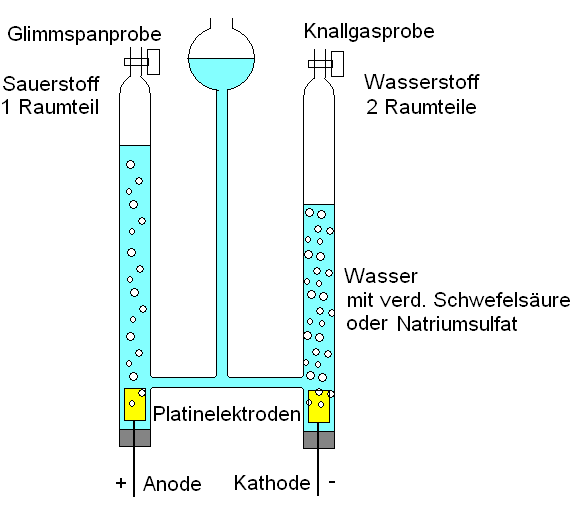
Reinstoffe, die noch in andere Stoffe zerlegt werden können, sind chemische Verbindungen. Reinstoffe, die nicht mehr weiter zerlegt werden können, sind chemische Elemente.
| Reinstoffe, die noch in andere Stoffe zerlegt werden können, sind chemische Verbindungen. Reinstoffe, die nicht mehr weiter zerlegt werden können, sind chemische Elemente. |
Stoffe

|
heterogene Stoffe
(stets Gemische) |
homogene Stoffe | 
|
homogene
Gemische |
Reinstoffe |

Das Element Wasser
Vorkommen
Wasser, Kohlenwasserstoffe (z.B. Benzin), häufigstes Element im Weltall (die Sonne besteht überwiegend aus Wasserstoff und Helium). Von 1000 Atomen im Universum sind 999 Atome entweder Wasserstoff oder Helium. Aus der Uratmosphäre sind die leichtesten Elemente entwichen.
Physikalische Eigenschaften
- farb- und geruchloses Gas, Siedepunkt. -253 °C = 20 K, sehr niedrig!
- Wasserstoff ist der leichteste aller Stoffe: Dichte 0,09 g/l (bei 0°C und 1,013 bar)
Chemische Eigenschaften
- Wasserstoff ist selbst brennbar, unterhält jedoch die Verbrennung nicht.
Wasserstoff + Sauerstoff —› Wasser
Energie wird frei (exotherm)
Versuch Reaktion von Eisen mit Schwefel
Durchführung
5,6 g Eisenpulver und 3,2 g Schwefelpulver werden abgewogen und in einer Reibschale gut gemischt.
Das Gemenge füllt man in ein trockenes Rggl. und erhitzt es oben mit dem Brenner.
Nach dem Einsetzen der Reaktion wird das Reagenzglas zur Sicherheit über eine Porzellanschale gehalten.
Wenn die Reaktion abgeklungen und das Reagenzglas halbwegs abgekühlt ist, zerstößt man es in einem Becherglas mit kaltem Wasser, damit das Reaktionsprodukt freigesetzt wird.
Beobachtung
Das Reaktionsgemisch glüht unter starker Wärmeentwicklung vollständig durch. Nach dem Abkühlen bleibt eine graubraune, feste Masse.
Ergebnis
Eisen reagiert mit Schwefel zu einer chemischen Verbindung:
Eisen + Schwefel —› Eisensulfid
Beteiligung von Energie an chemischen Reaktionen
Versuch
Verbrennung von Magnesium als Beispiel für eine exotherme Reaktion
Alle chemischen Reaktionen sind von Energieänderungen begleitet.
exothermer Vorgang: Energie wird frei
endothermer Vorgang: Energie muss dauernd zugeführt werden
Beispiele
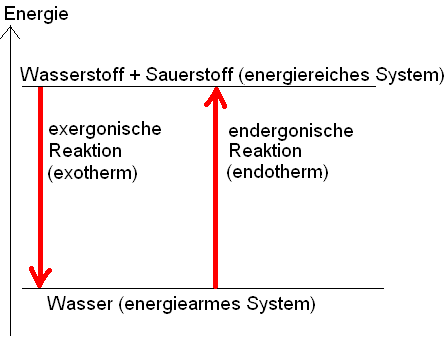
Die bei der Bildung einer bestimmten Portion einer Verbindung aus den Elementen freiwerdende Energie muss bei der Zerlegung dieser Verbindungsportion in die Elemente wieder aufgewendet werden.
Weitere Energieformen, die bei chemischen Reaktionen auftreten können:
Versuche
Reaktion von Zink mit Iod zu Zinkiodid und anschließende Elektrolyse - Motor
Viele exotherme Reaktionen müssen durch anfängliche Energiezufuhr gestartet werden.(Aktivierungsenergie)
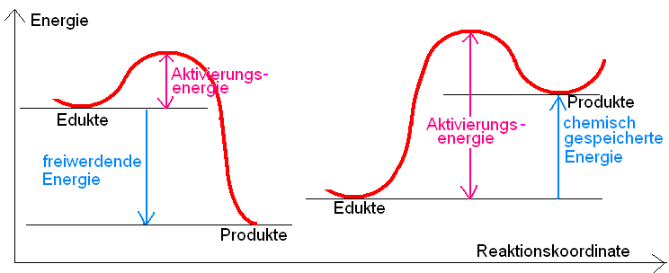
Begriffe stabiler, instabiler, metastabiler Zustand erklären (Kugelmodell).
Metastabiler Zustand der Kohlenstoffverbindungen! (Waldbrand).
Kinetische Deutung: Analogie Zündhölzer und Schachtel.
Modellversuch: Saugheber zur Veranschaulichung der Aktivierungsenergie
Beispiel
Katalysatorwirkung: Herabsetzung der Aktivierungsenergie
Versuch Verbrennung von Magnesiumband
Durchführung
Streifen Magnesiumband mit der Tiegelzange fassen, an der Bunsenflamme entzünden und über eine feuerfeste Unterlage halten. (nicht direkt in das Licht sehen!)
Beobachtung
Magnesium verbrennt mit blendend hellem Licht zu einem weißen pulverigen Rückstand.
Ergebnis
Magnesium verbindet sich in exothermer Reaktion mit Sauerstoff zu Magnesiumoxid:
Magnesium + Sauerstoff —› Magnesiumoxid
Wichtige Begriffe zur Unterrichtseinheit
Reinstoff
Reinstoffe sind aus Teilchen einer Art aufgebaut und besitzten stets gleichbleibende Eigenschaften (z.B. Dichte, Schmelz-und Siedepunkt, Farbe, Geruch)
Verbindung
Chemische Verbindungen bestehen aus mindestens zwei miteinander verbundenen Teilchen.
Elemente
Elemente sind Reinstoffe, die nur aus einer Atomsorte bestehen.
Stoffgemisch
Gemisch aus mindestens zwei Reinstoffen.
homogenes und heterogenes Stoffgemisch
- Homogen: Reinstoffe sind absolut gleichmäßig verteilt (z.B. Salzwasser)
- Heterogen: Reinstoffe sind ungleichmäßig zusammengesetzt (z.B. Granit)
Legierung
Homogenes Stoffgemisch aus zwei festen Reinstoffen (z.B. Bronze aus Kupfer und Zinn)
Lösung
Homogenes Stoffgemische verschiedener Stoffe, in dem die Zerteilung bis zur Stufe der Moleküle, Atome oder Ionen reicht.
Gemenge
heterogenes Gemisch aus zwei festen Reinstoffen (z.B. Granit)
Suspension
heterogenes Gemisch aus einem festen und einem flüssigen Reinstoff
(z.B. Wasser und Sand)
Emulsion
heterogenes Gemisch aus zwei flüssigen Reinstoffen (z.B. Milch aus Fett und Wasser)
Nebel / Schaum
heterogenes Stoffgemisch bei dem Flüssigkeitströpfchen in einem Gas oder Gasgemisch feinstverteilt sind.
Rauch
heterogenes Gemisch, in dem Feststoffteilchen in einem Gas oder Gasgemisch feinstverteilt sind.
Chromatographie
Stofftrennung über zwei Phasen. Die eine Phase ist unbeweglich (z.B. Filterpapier),
die andere beweglich (z.B. Wasser)
Destillation
Trennung eines homogenes Gemisches zweier Flüssigkeiten auf Grund ihrer unterschiedlicher Siedepunkte durch Verdampfen und anschließendem Kondensieren.
Aggregatszustand
Zustand eines Stoffes: fest, flüssig oder gasförmig.
Sublimation
direkter Übergang vom festen in den gasförmigen Aggregatszustand.
Kondensation
Übergang vom gasförmigen in den flüssigen Aggregatszustand.
Ion
elektrisch geladenes Teilchen (Atom oder Molekül)
Kation: positiv geladenes Ion
Anion: negativ geladenes Ion
Molekül
Verbindung, welche mindestens aus zwei Atomen aufgebaut ist.
|